
新闻网讯(通信员杨雪)11月1日,Science Advances在线发表武汉大学人命科学学院、武汉大学泰康人命医学中心梁毅教讲课题组的最新扣问效果。论文题为“Amyloid fibril structures and ferroptosis activation induced by ALS-causing SOD1 mutations”(《ALS致病卵白质SOD1突变指令的淀粉样纤维结构和铁死亡激活机制》)。武汉大学人命科学学院博士后王利强、中国科学院生物与化学交叉扣问中心博士扣问生马烨阳和武汉大学人命科学学院2023级博士扣问生张沐雅为论文的共同第一作家反差 英文,梁毅熟悉和中国科学院生物与化学交叉扣问中心刘聪熟悉为通信作家。
该扣问初次在原子水平上领路了铜锌超氧化物歧化酶(SOD1)病理突变体H46R和G85R淀粉样纤维的高诀别率冷冻电镜结构(3.11Å和2.97Å),揭示了H46R和G85R淀粉样纤维对神经细胞铁死亡激活调控并诱发财眷遗传型肌萎缩侧索硬化症(ALS)新机制,为发展新的针对SOD1突变体纤维的ALS诊治药物奠定了基础。此外,通过激光共聚焦显微和免疫思路等要领,该扣问团队还发现,与野生型SOD1纤维比较,这些突变体纤维具有更强的指令细胞内源SOD1鸠集和线粒体功能零星的技巧,显贵激活受谷胱甘肽过氧化物酶4(GPX4)调整的神经细胞铁死亡。
该扣问初次揭示了H46R纤维、G85R纤维和野生型SOD1纤维之间的结构各异,在原子水平上揭示了SOD1病理突变体H46R和G85R淀粉样纤维激活细胞铁死亡的机制,解释金属离子集结区域的两种病理突变王人梗概梗阻SOD1纤维中垂危的相互作用(举例盐桥),使得这些病理突变体纤维结构变成了相互雷同但又宽裕不同于野生型SOD1纤维的构象,凸显了具有相同功能的SOD1病理突变体可能推崇出相同的纤维结构的垂危性,并使得发展新的针对SOD1突变体纤维过火激活的铁死亡的ALS诊治药物成为可能,具有垂危的科学兴味。
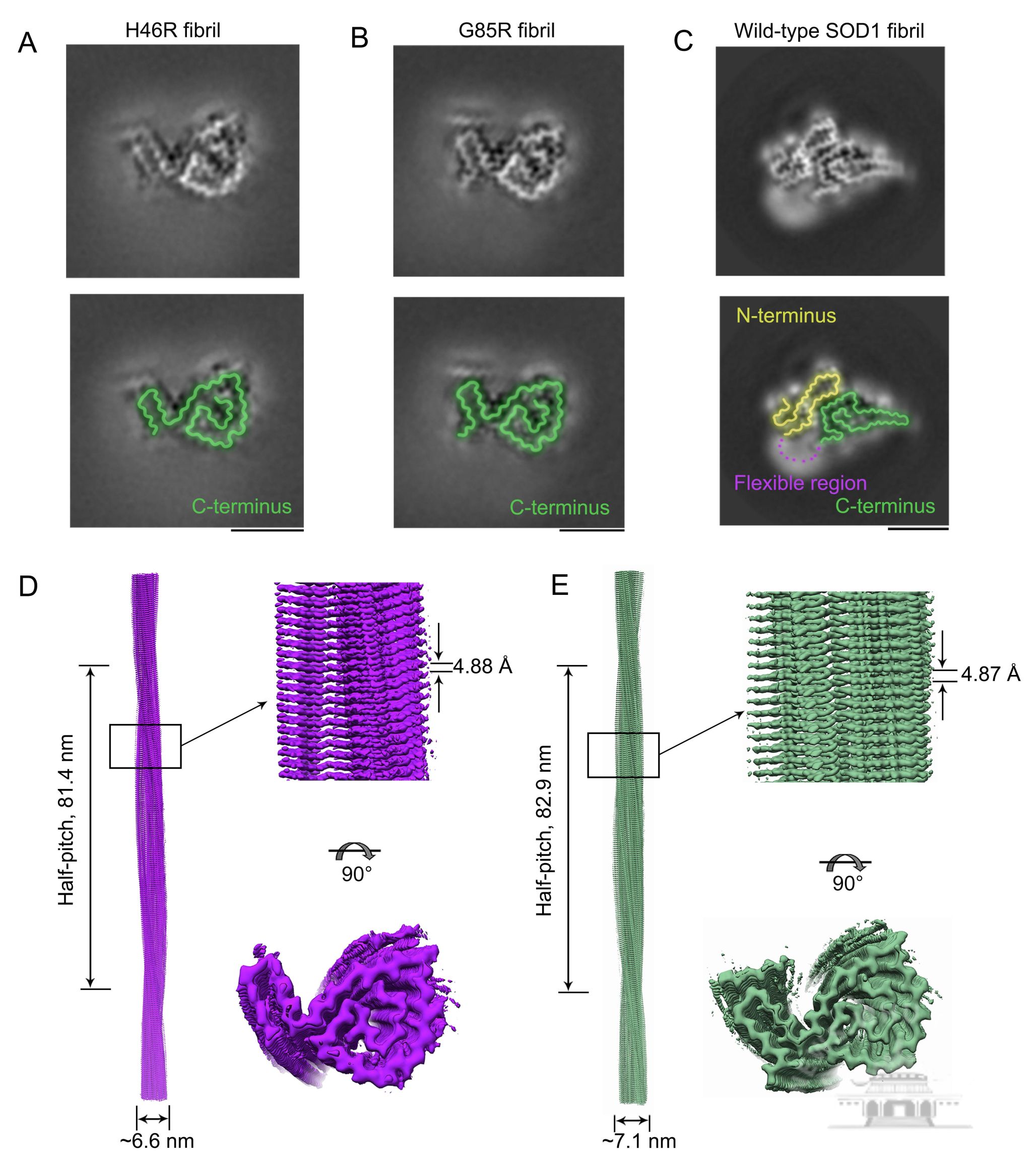
SOD1病理突变体H46R和G85R的纤维结构具有相同的仅由C端片断构成的纤维中枢,与在N端和C端间变成了踏实盐桥作用的野生型纤维结构大不相通
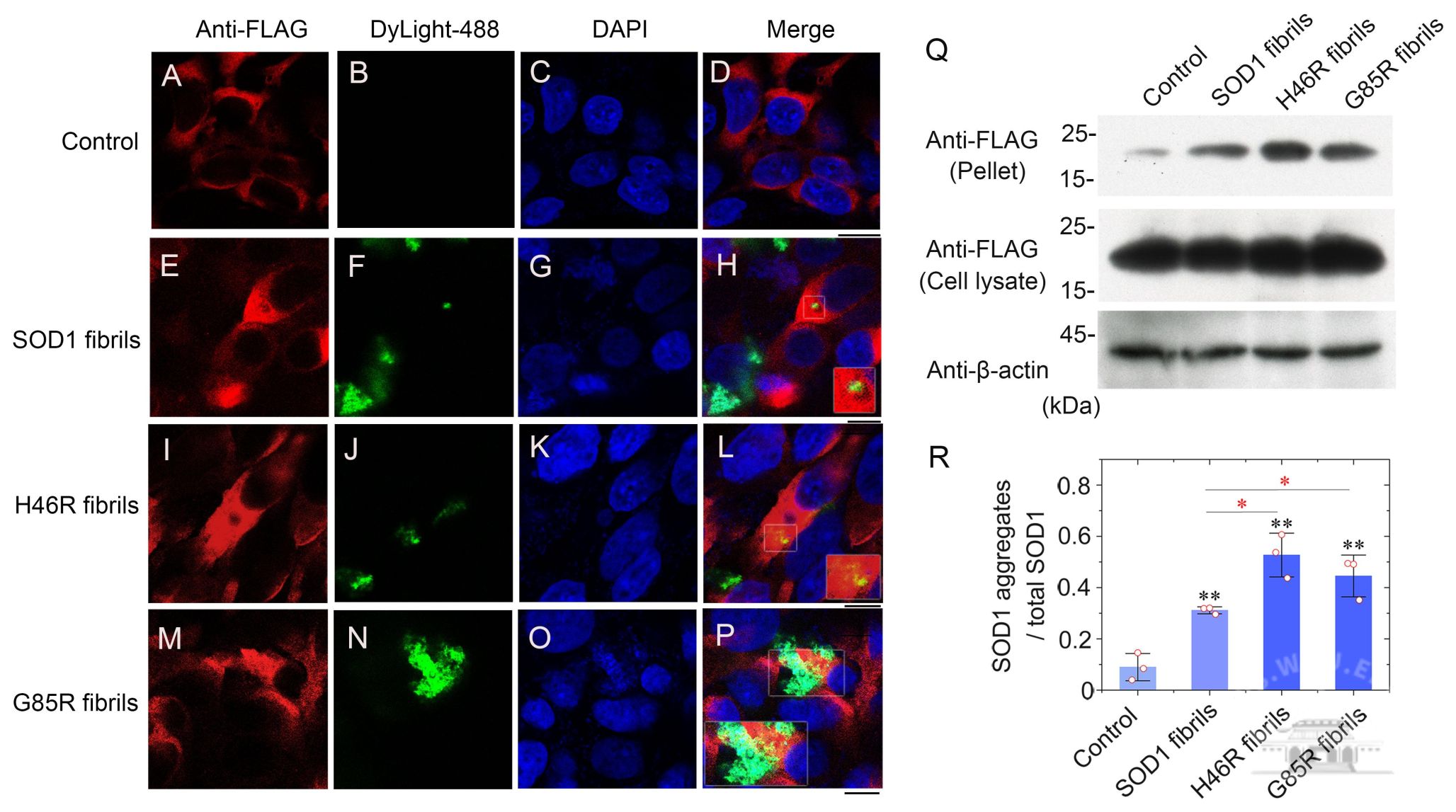
SOD1病理突变体H46R和G85R的纤维种子具有更强的指令细胞内源SOD1鸠集(“模板折叠”)的技巧
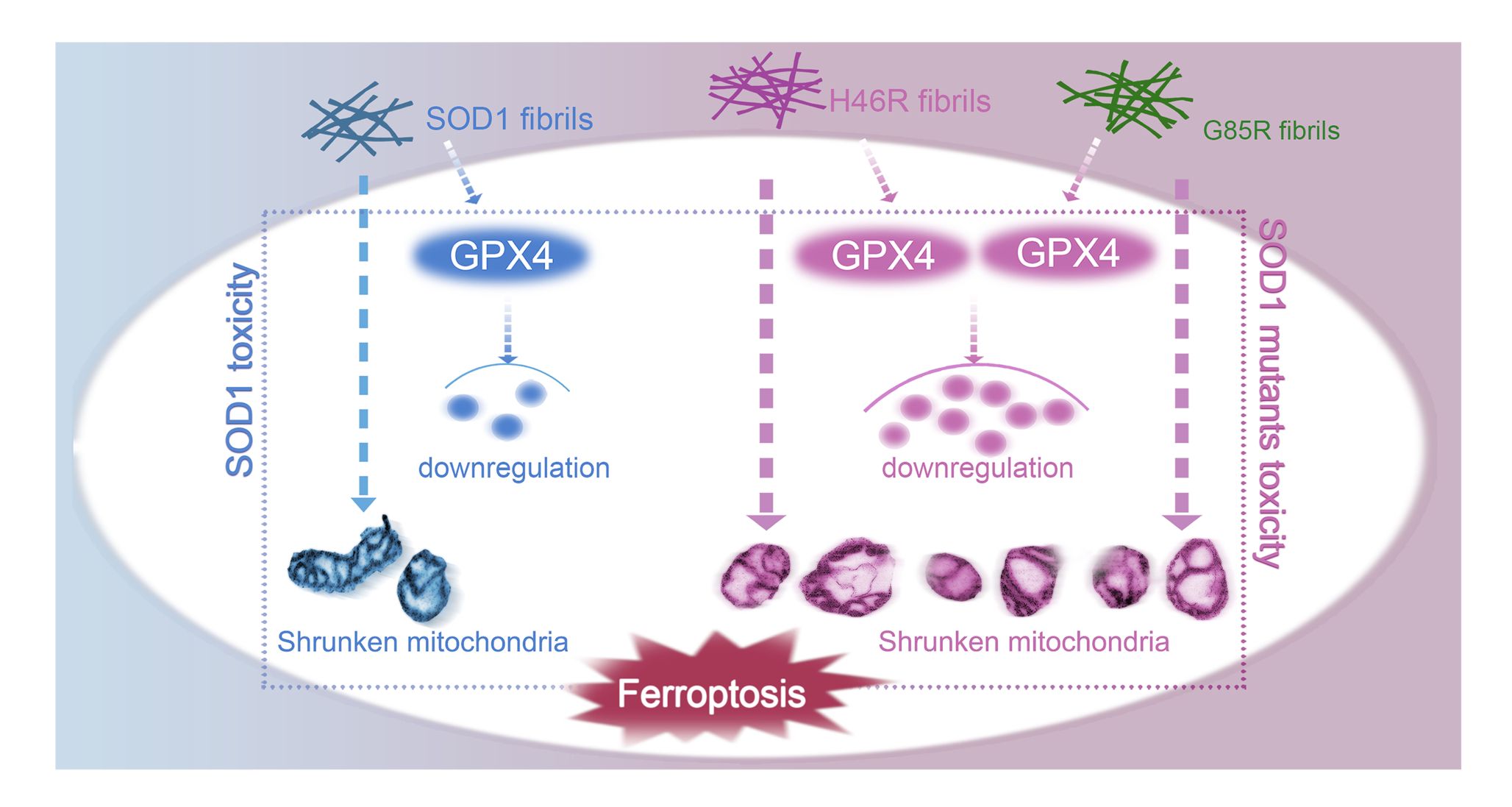
SOD1病理突变体H46R和G85R的纤维种子显贵激活受GPX4调整的神经细胞铁死亡
该扣问使命获取了国度当然科学基金、武汉大学泰康人命医学中心科研经费、深圳市科技鼎新委员会科技酌量和中国博士后科学基金等的赈济,也获取了武汉大学科研众人处事条目平台冷冻电镜机组的浮松赈济。武汉大学土木确立工程学院王刚直熟悉、深圳市东谈主民病院神经内科邹良玉熟悉等参与了该项扣问,武汉大学科研众人处事条目平台冷冻电镜机组特聘高等工程师李丹阳和推行员李香凝在数据汇集使命中提供了垂危协助。
论文谀媚:https://www.science.org/doi/10.1126/sciadv.ado8499
(供图:人命科学学院 实习生:王雅兰 剪辑:张丽平)反差 英文